|
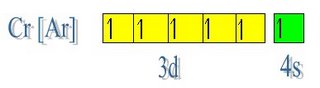
| hibridacion sp3 forma alotropica del diamante. |
http://www.google.com.mx/imgres?imgurl=https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEgUKYBrScZJKNkiishaRKN0SA67MalGGINsmb1GFnJQ3b4FmyfIGozDorI30PYk2BYKS0sK8DgXKsWAF7QgFBA29-PFNSFz_pC04mD_nzMMHFu4goOw3jmg9d0lQvBOlA7jNa1SsgzWjS3-/s320/Image4456.gif&imgrefurl=http://edymar1990.blogspot.com/2010/03/quimica-del-carbono-2.html&usg=__titv9yJj-ZkebgK4q10U6PtzeIU=&h=175&w=320&sz=68&hl=es&start=0&zoom=1&tbnid=87AxAtBHGtMJJM:&tbnh=111&tbnw=203&ei=SSvwTc7IBqPq0QGy7cXbAw&prev=/search%3Fq%3DESQUELETOS%2BDE%2BLOS%2BELEMENTOS%2BHIBRIDACION%2BSP3%26hl%3Des%26biw%3D1276%26bih%3D839%26gbv%3D2%26tbm%3Disch&itbs=1&iact=rc&dur=123&page=1&ndsp=24&ved=1t:429,r:5,s:0&tx=54&ty=87
http://www.jccanalda.es/jccanalda_doc/jccanalda_ciencia/quimica/articulos-quimica/carbono-2.htm